Avances científicos y tecnológicos en el modelo de Ernest Rutherford |
Características del modelo atómico de Rutherford
Limitaciones
del modelo
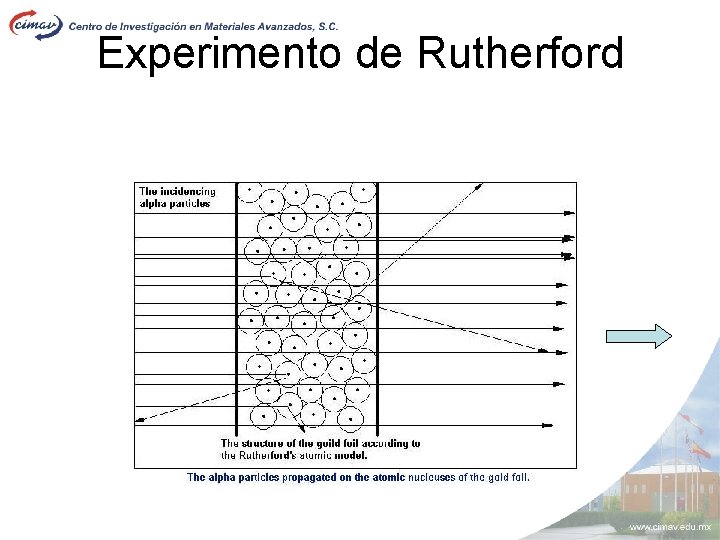
Experimento
de Rutherford
|
James Chadwick: el físico que descubrió el neutrón. Nacido en 1891 en condado de Chesire, al norte de Inglaterra, James Chadwick ha sido reconocido por su trayectoria como físico y por adjudicarse el Premio Nobel de Física en 1935 por el descubrimiento del neutrón. A pesar de que fue Ernest Rutherford quien planteó por primera vez la existencia de esta partícula, mientras dictaba una conferencia en la Royal Society de Londres en 1920, Chadwick –quien trabajó con él en el Laboratorio Físico de Manchester- logró demostrarlo a través de una investigación, la cual fue publicada en la edición de la revista Nature el 27 de febrero de 1932. Los neutrones son partículas subatómicas y sin carga eléctrica que componen, junto a los protones y electrones, el núcleo de un átomo. Los átomos son las partículas que forman la materia, es decir, de lo que todo está formado. A partir de 1920 se realizaron varios experimentos que intentaron comprobar las sugerencias de Rutherford, hasta que en 1932, Chadwick logró verificar la presencia de estas partículas sin carga en y del mismo tamaño de un protón, del cual ya se tenía conocimiento. Los neutrones tienen una función fundamental, y es que sirve para mantener estable al átomo, dándole la masa necesaria para que pueda sostenerse a sí mismo. Su descubrimiento no solo le valió un premio Nobel a Chadwick, sino que también contribuyó al desarrollo de la fisión nuclear y de la bomba atómica. |
Ernest Rutherford :Gráfica el experimento y conclusiones |
James Chadwick :Gráfica y conclusiones |
Niels Bohr :Gráfica y conclusiones |
|
¿Qué limitaciones tiene el modelo atómico de Bohr? La creencia de que el átomo estaba compuesto por un núcleo cargado positivamente rodeado por electrones cargados negativamente se mantuvo hasta el año 1932. El modelo atómico de Bohr encajaba bien cuando se trataba del átomo de hidrógeno. Sin embargo, al aplicar el mismo modelo en otros átomos, especialmente con números atómicos altos, la energía de los electrones de un mismo nivel variaba. Esta variación de energía no tenía explicación en el modelo de Niels Bohr y, por lo tanto, era necesario corregir el modelo. La propuesta de corrección fue considerar que dentro de un mismo nivel energético existían otros subniveles. Estos niveles surgieron de forma natural añadiendo correcciones relativistas y órbitas elípticas. El descubrimiento del neutrón llegó en 1932 por parte
de James Chadwick. La aparición de esta nueva partícula atómica acercó a los
científicos a un modelo más real del átomo. |



No hay comentarios:
Publicar un comentario